大多数活泼金属的氯化物和一些盐类在熔融状态下能导电,说明这些化合物中存在带正电荷的阳离子和带负电荷的阴离子,这些阴、阳离子结合形成离子化合物。
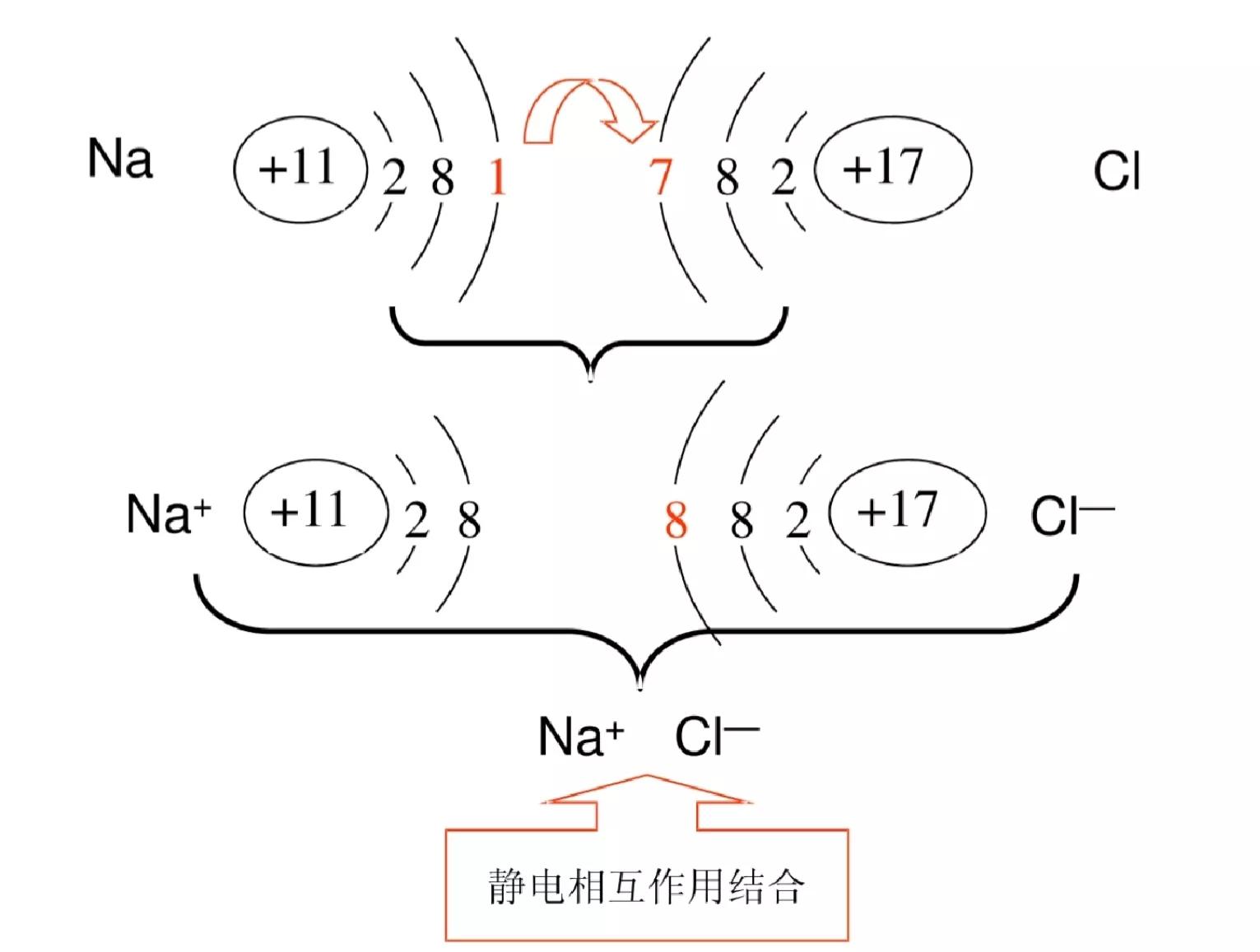
离子键的形成示意图
离子键的形成
在氯化钠中,阴、阳离子之间的静电引力使阴、阳离子相互吸引,阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键(ionic bond),整个体系达到能量最低状态。
离子键是带相反电荷离子之间的相互作用,成键微粒为阴、阳离子,本质是静电作用,其成键元素一般是活泼金属元素(I A、IIA)和活泼非金属元素(VIA、VIIA)。不是所有的金属与非金属元素之间形成的化学键都是离子键,如AlCl3;非金属元素之间也可能形成离子键,如铵根离子与酸根离子之间。
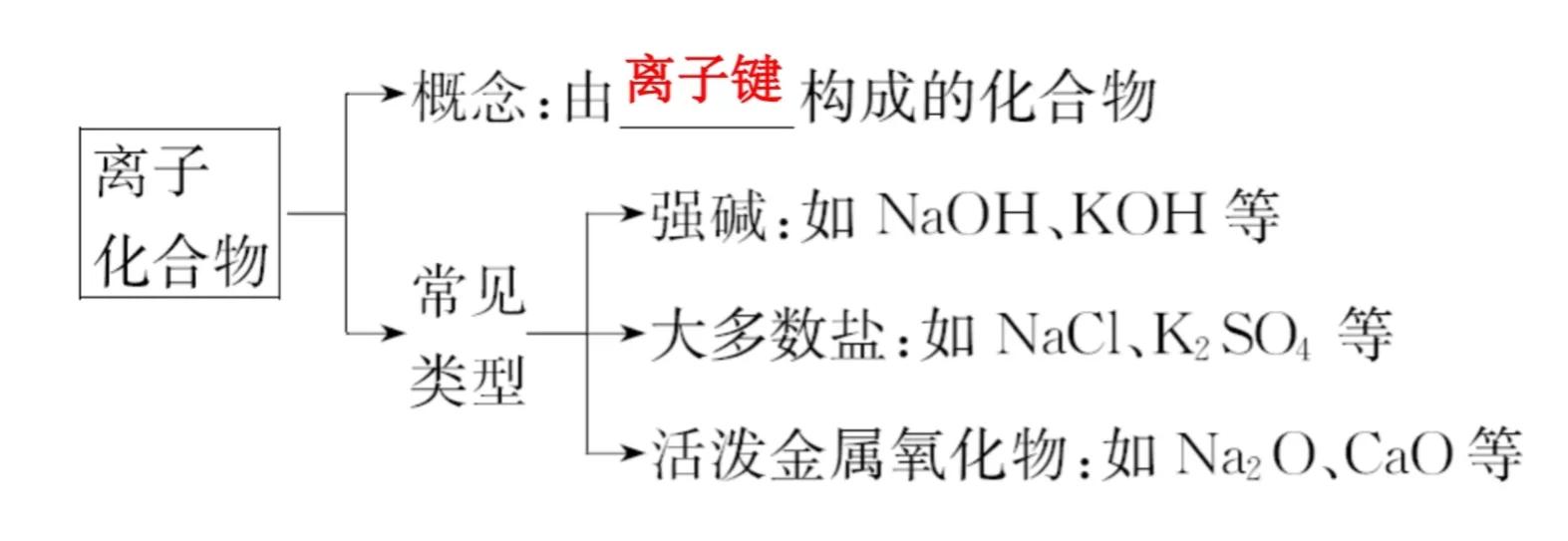
离子化合物
有的离子化合物中只含有离子键,如MgO、NaF、MgCl2等;有的既含有离子键又含有共价键,如NaOH等。可以用如下的电子式来表示其中的化学键。

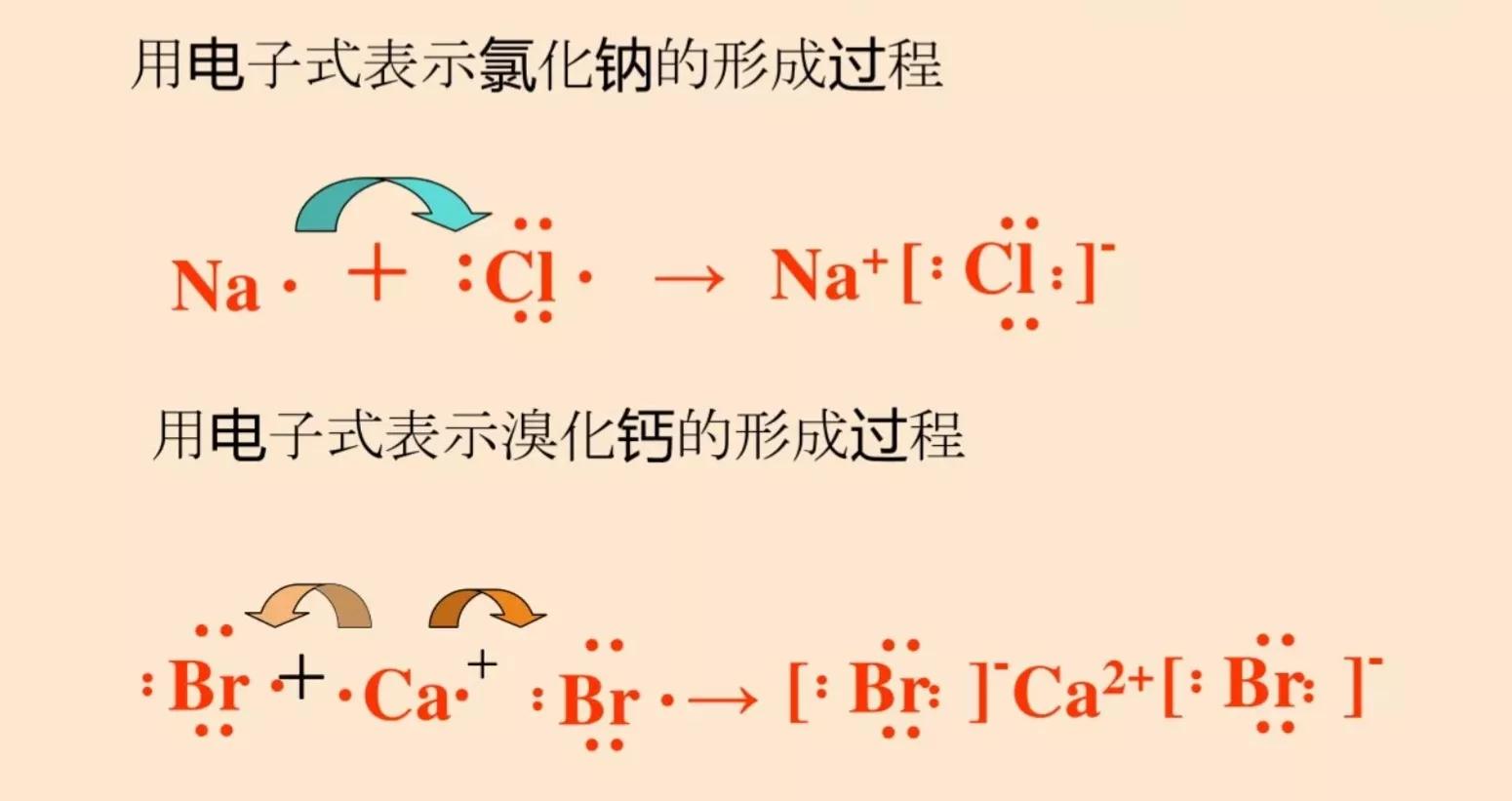
通常情况下,阴、阳离子可以看成是球形对称的。阴、阳离子的电荷分布也是球形对称的,它们在空间各个方向上的静电作用相同,所以在各个方向上都可以与带相反电荷的离子发生静电作用,且在静电作用能达到的范围内,只有空间条件允许,一个离子可以同时吸引多个带相反电荷的离子。因此离子键没有方向性和饱和性。
离子晶体
由阴、阳离子按一定方式有规则地排列形成的晶体称为离子晶体(ionic crystal)。在常温、常压下,简单的阴、阳离子形成的离子化合物大多数以晶体的形式存在。如NaCl、MgO等都属于离子晶体。

蓝矾(CuSO4•5H2O)
离子晶体一般具有一定的硬度和较高的熔点。离子晶体中阴、阳离子间相互作用力的大小可用晶格能(lattice energy)来衡量。晶格能(符号为U)是指拆开1mol离子晶体形为气态阴离子和气态阳离子时吸收的能量或气态离子形成1mol离子晶体时释放的能量,通常取正值。
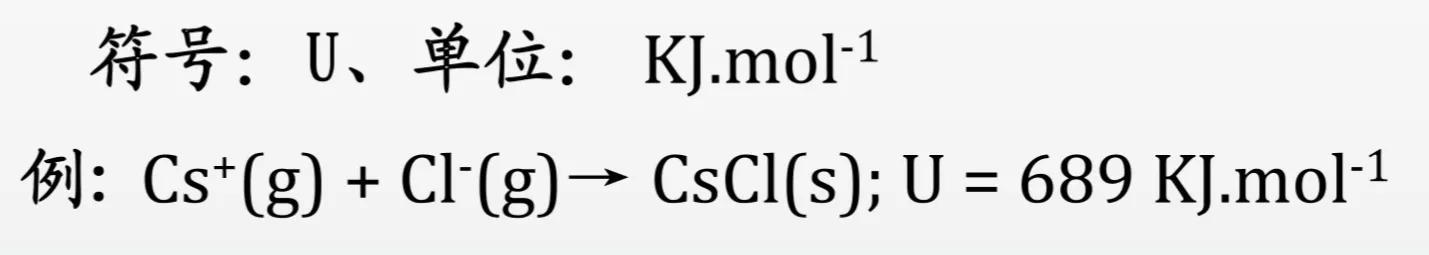
晶格能的大小与阴、阳离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比。晶格能越大,离子键越牢固,破坏离子键时吸收的能量越多,离子晶体越稳定。一般而言,晶格能越大,离子晶体的熔点越高、硬度越大。如离子化合物MgO的晶格能为3791kJ/mol,熔点高达2852℃,是优良的耐高温材料。
一些钠的卤化物和碱金属的氯化物的熔点表,因Na和F的离子半径小,故其离子化合物的晶格能较大
离子晶体有多种晶体结构类型,其中氯化钠型和氯化铯型是两种常见的离子晶体结构类型,都是AB型离子化合物。
1.氯化钠型
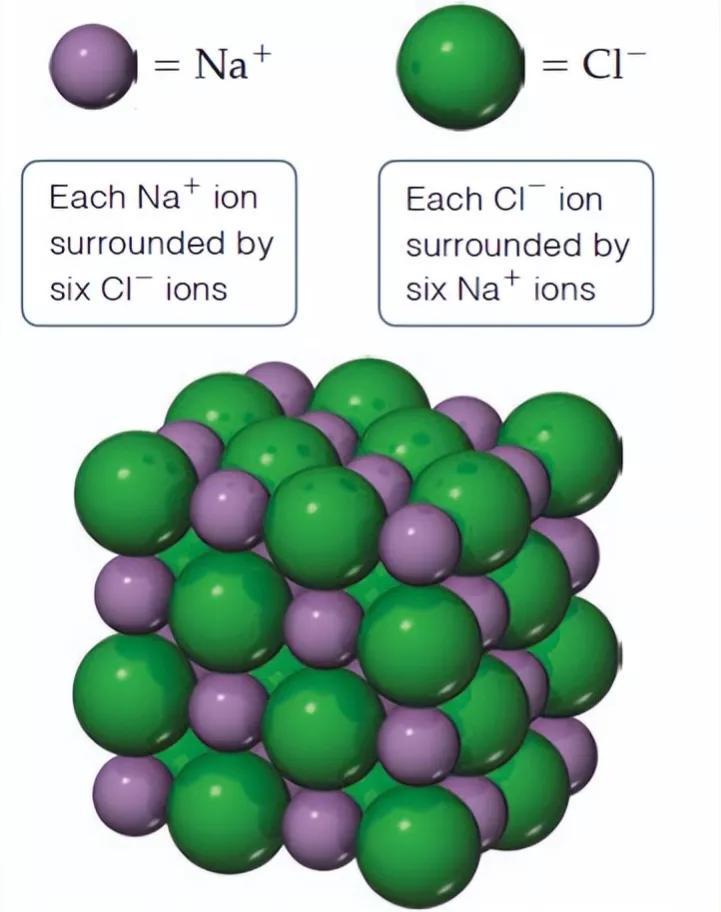
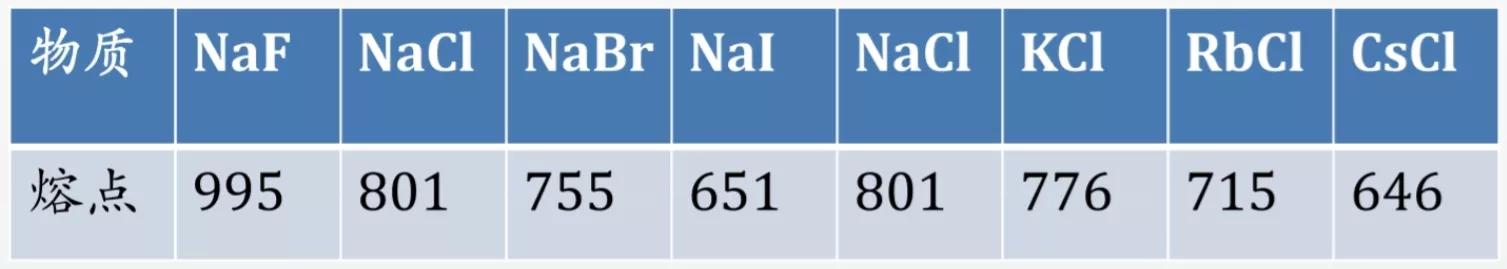
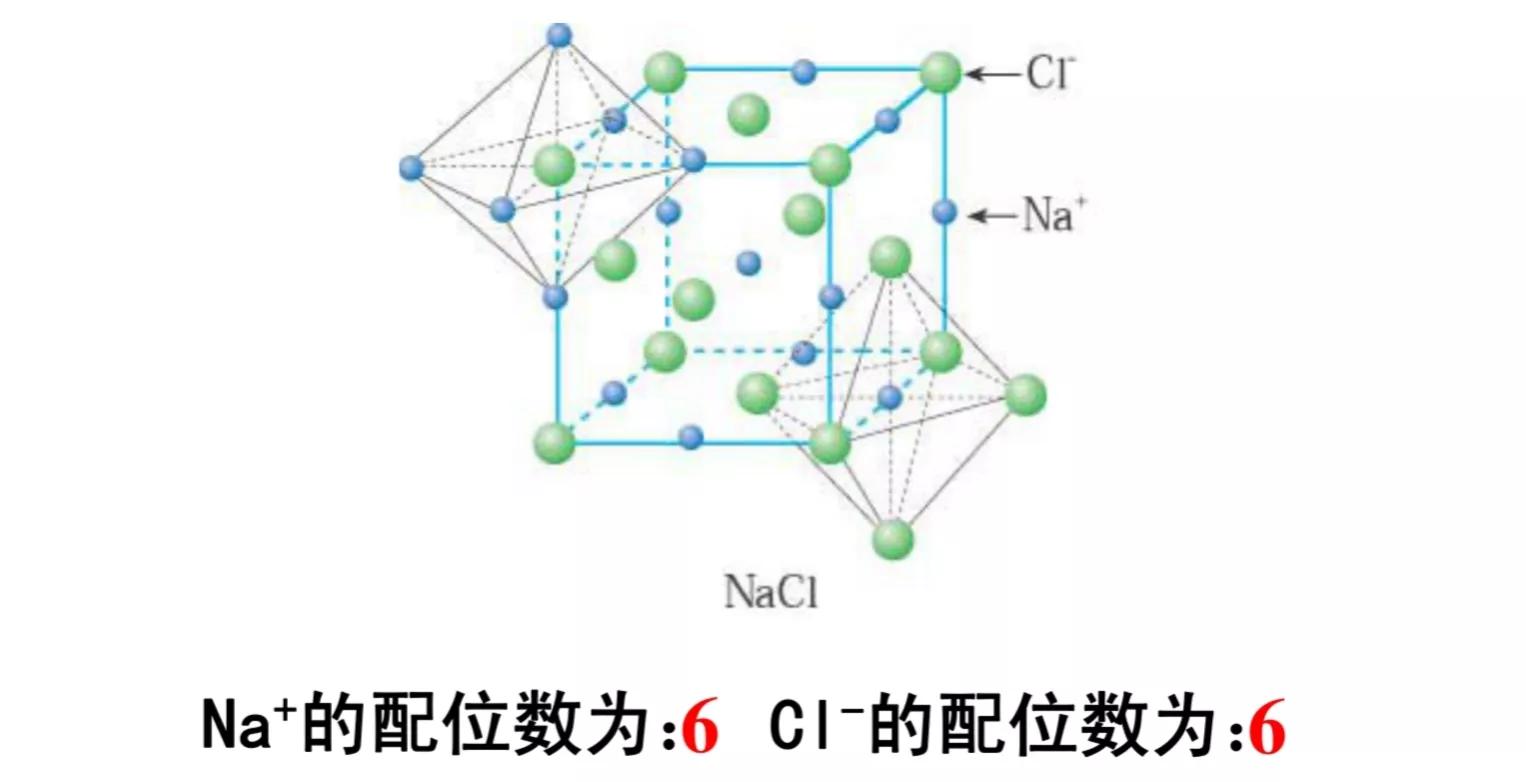
在氯化钠晶体中,钠离子和氯离子周围都排列着6个带有相反电荷的离子,即每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子;每个NaCl晶胞含有4个钠离子和4个氯离子。
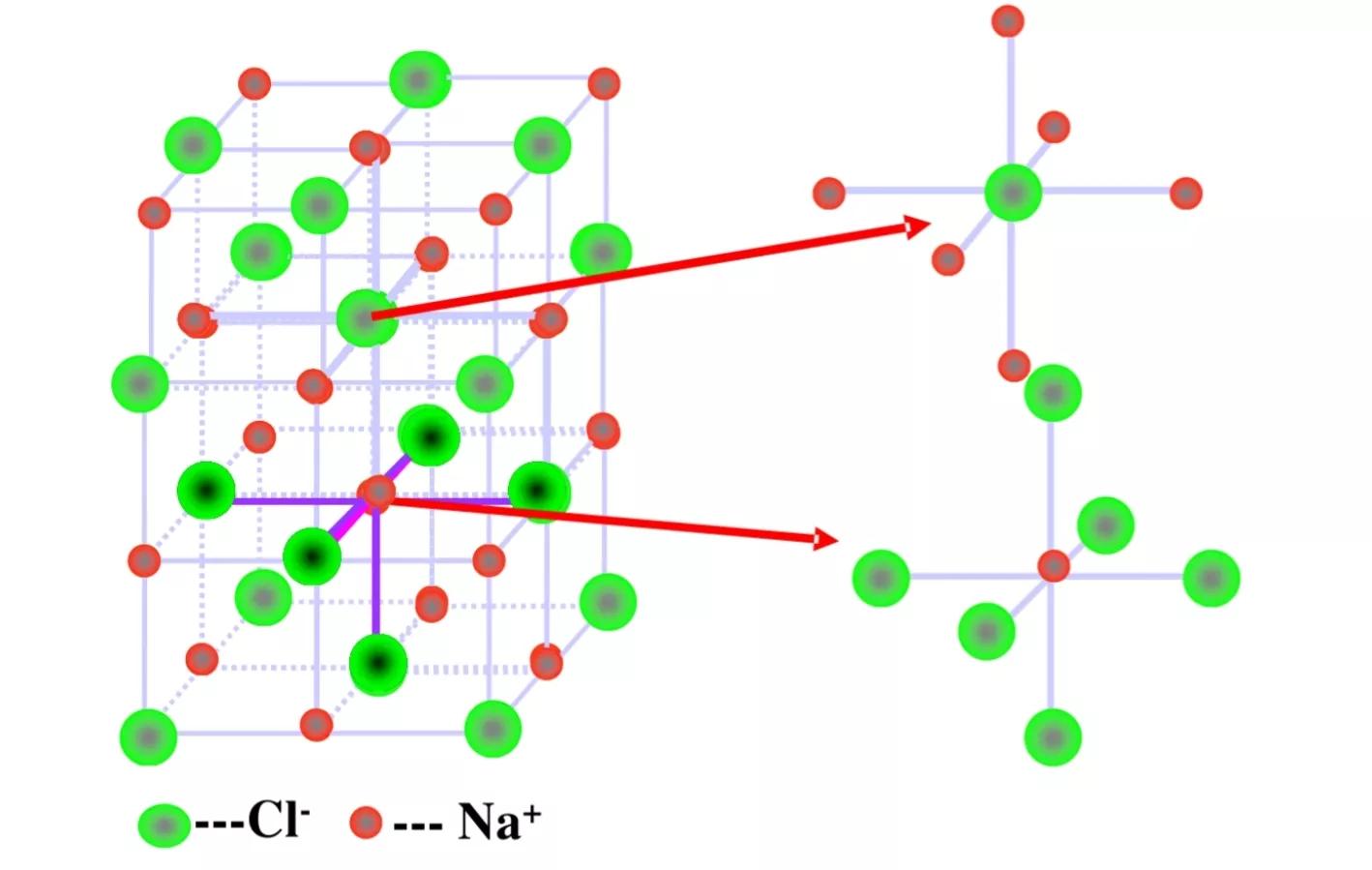
NaCl的晶体结构模型
常见的氯化钠型离子晶体还有KCl、CaO、MgO等。
2.氯化铯型
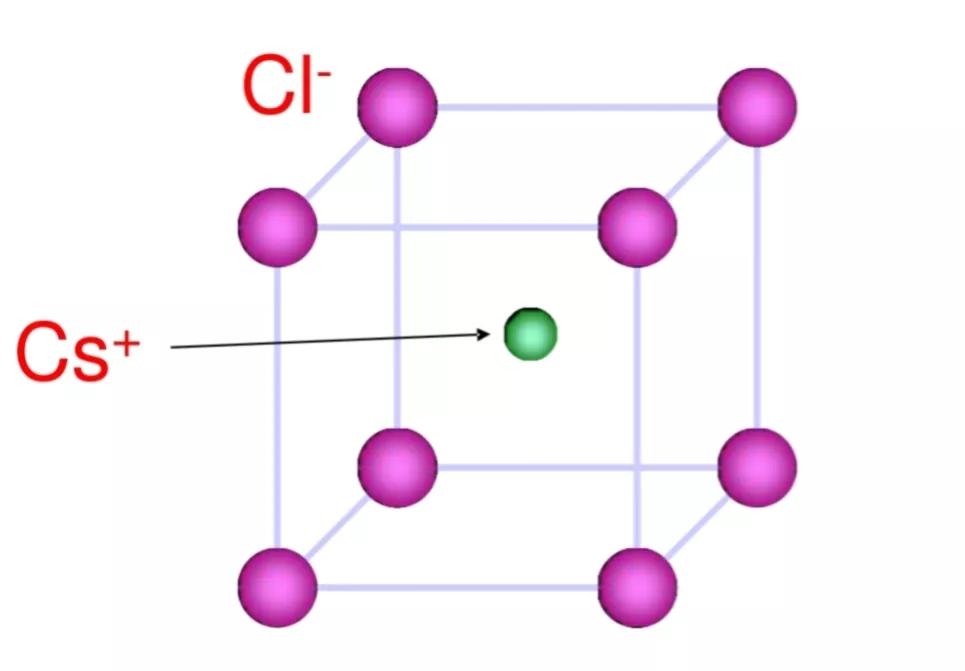
CsCl晶胞结构示意图,铯离子和氯离子的配位数都为8
在氯化钠晶体中,每个钠离子周围有6个氯离子,而在氯化铯晶体中,每个铯离子的周围有8个氯离子。两者数目之所以不同,主要在于离子半径的差异。铯离子的半径大于钠离子,因而可以吸引更多的氯离子。可见离子晶体中不同离子周围异电性离子数目(配位数)主要取决于阴、阳离子的相对大小。
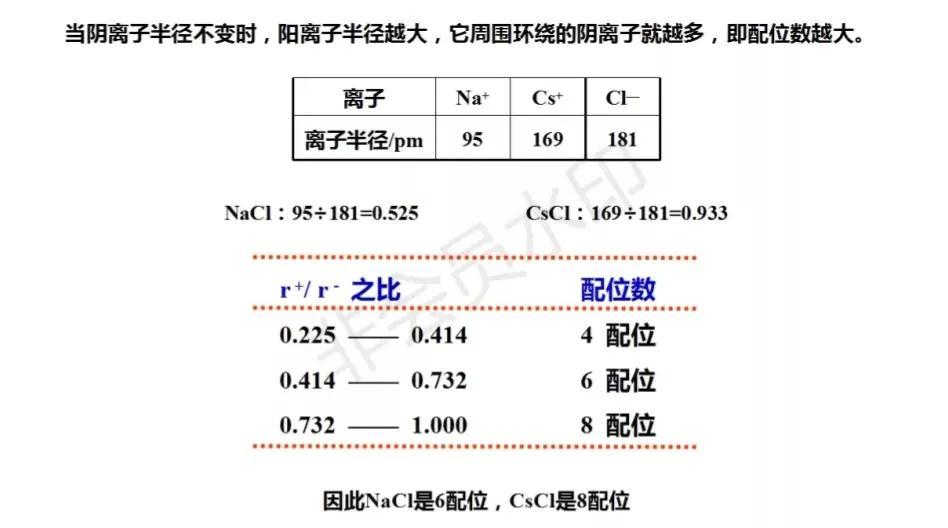
AB型离子晶体中阴、阳离子半径比与配位数的关系
如果仅从静电定律考虑,当离子半径越小,阴、阳离子的大小越接近,所形成的离子晶体的配位数越多,空间利用率越高,阴、阳离子可以更充分接触,异号离子之间的相互作用力越强,而同号离子之间的排斥力越弱,离子晶体晶格能越大,体系越稳定。
3.氟化钙型
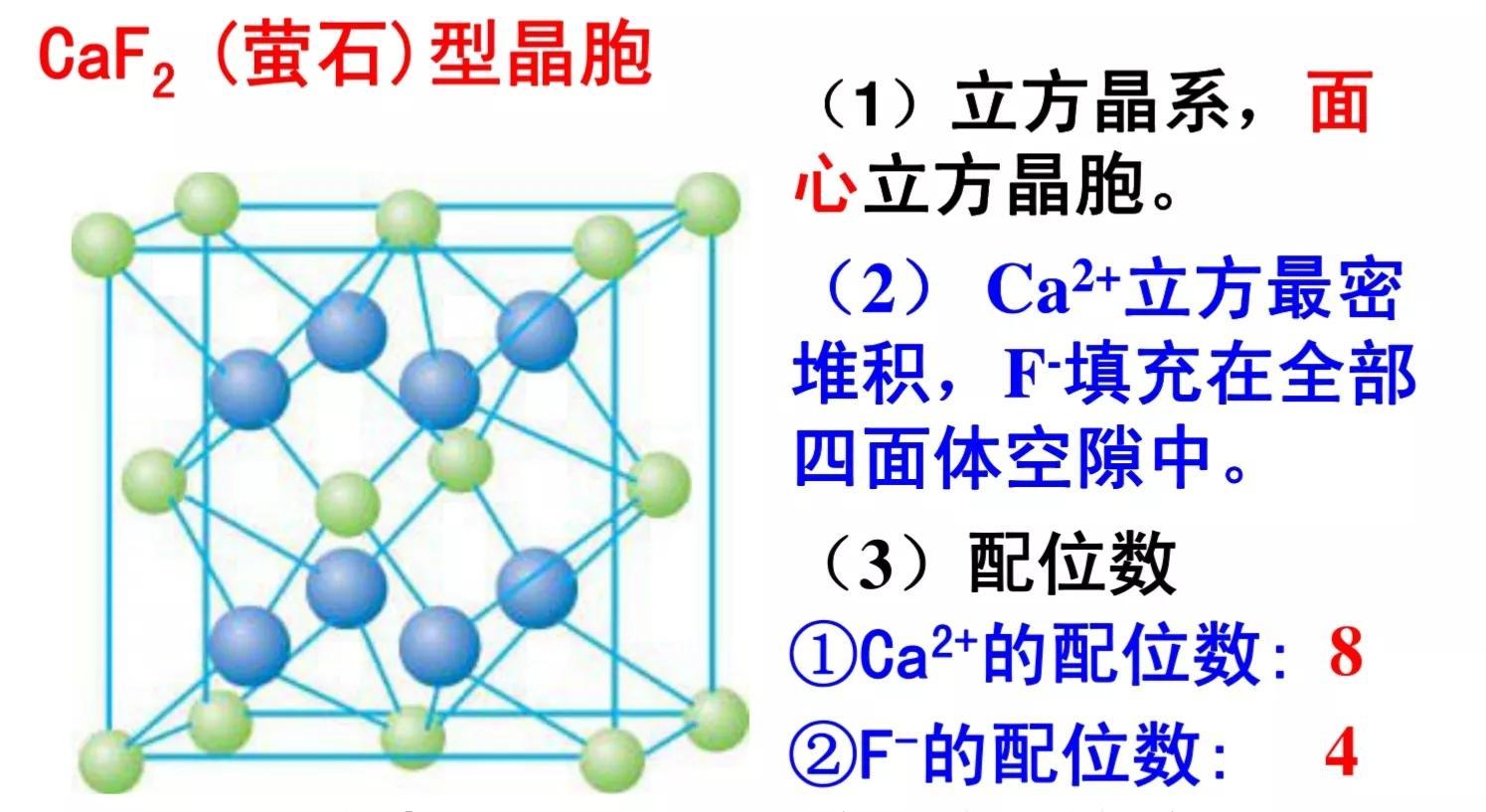
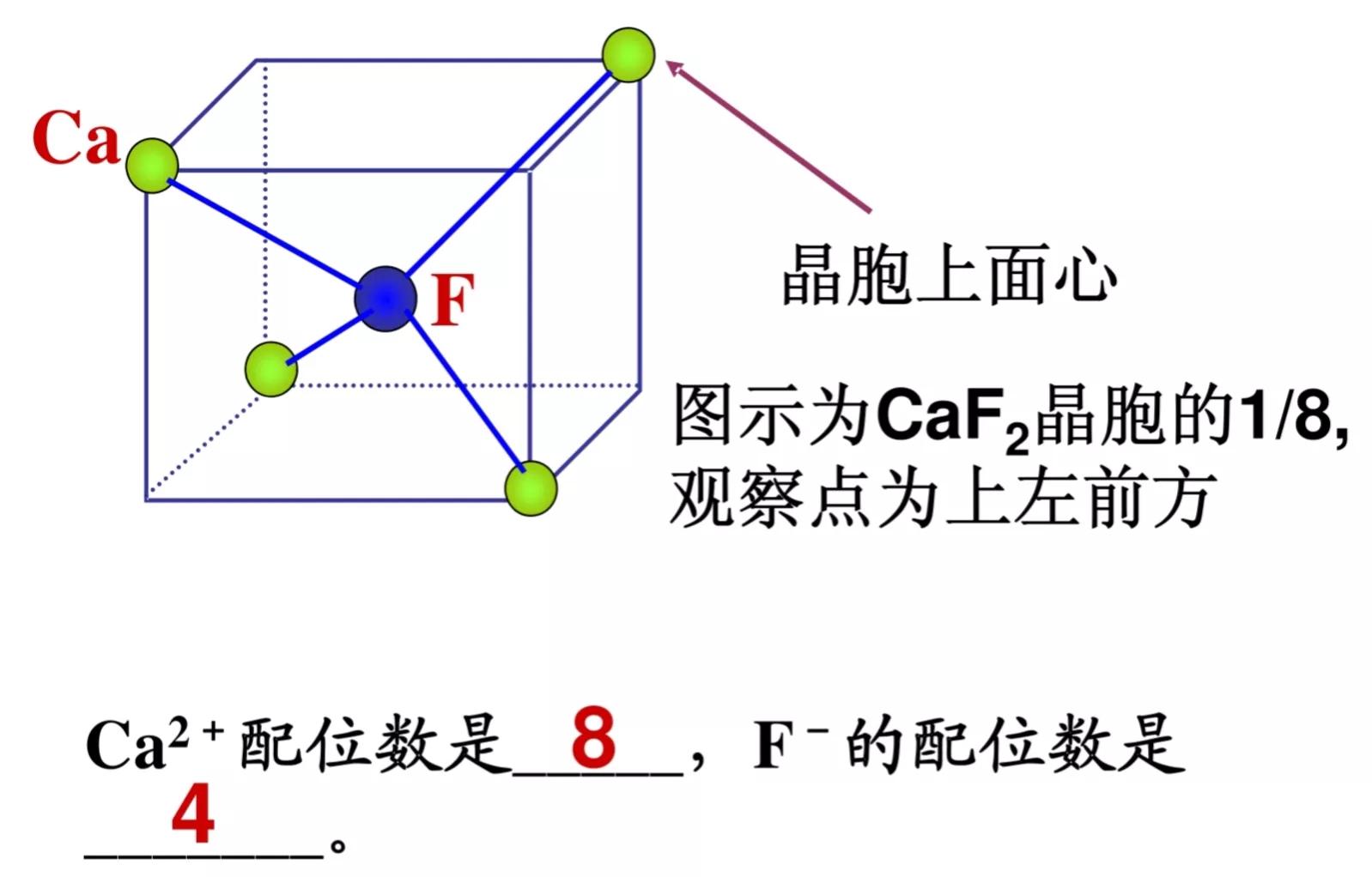
(氟化钙晶胞的1/8,观察点为上左前方)
4.硫化锌型
硫化锌结构有两种,一种是立方硫化锌,一种是六方硫化锌。
(1)立方硫化锌又名闪锌矿,其结构可看作S原子作立方最密堆积、Zn原子占据一半四面体空隙形成。
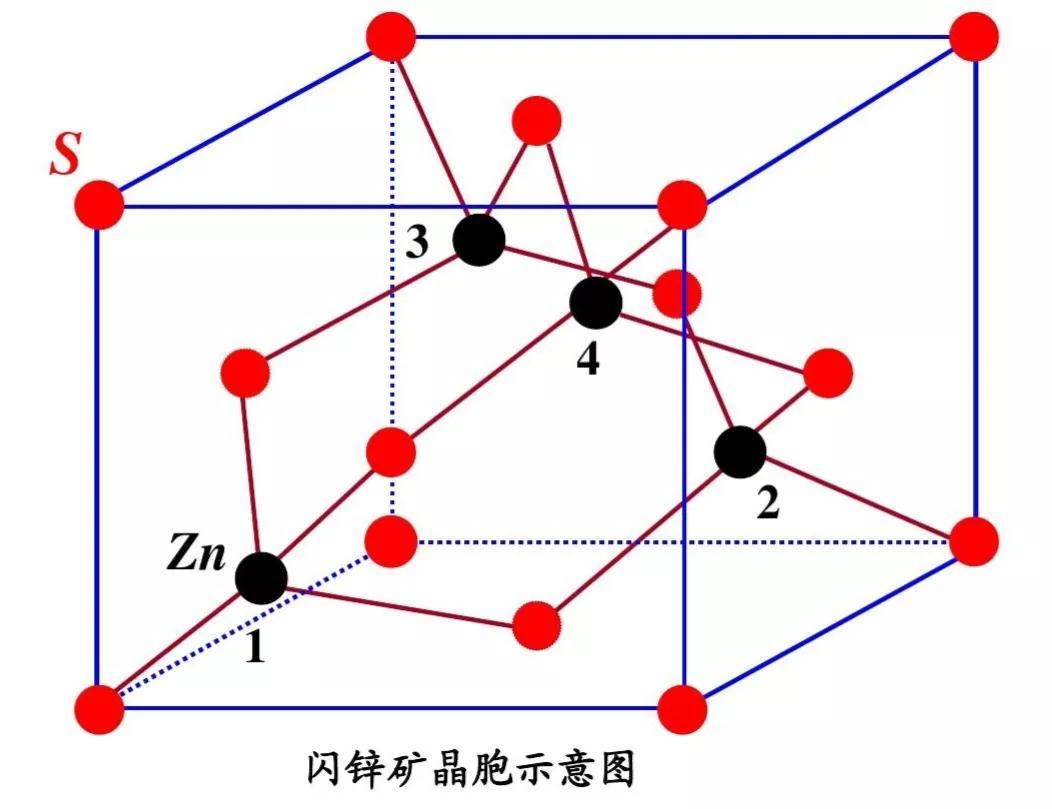
立方最密堆积有两种空隙:八面体与四面体空隙。四面体空隙由一个顶角原子与三个面心原子围成,空隙数目为8,均位于晶胞内部,是面心立方原子数4的2倍。八面体空隙由六个面心原子围成,或由8个四面体空隙围成。晶胞内部有1个八面体空隙,棱边中心各有1个八面体空隙。一个立方最密堆积拥有的八面体空隙数为1+12×1/4=4个,与面心立方原子数4相同。故立方最密堆积晶胞原子个数∶八面体空隙数∶四面体空隙数=4∶4∶8。
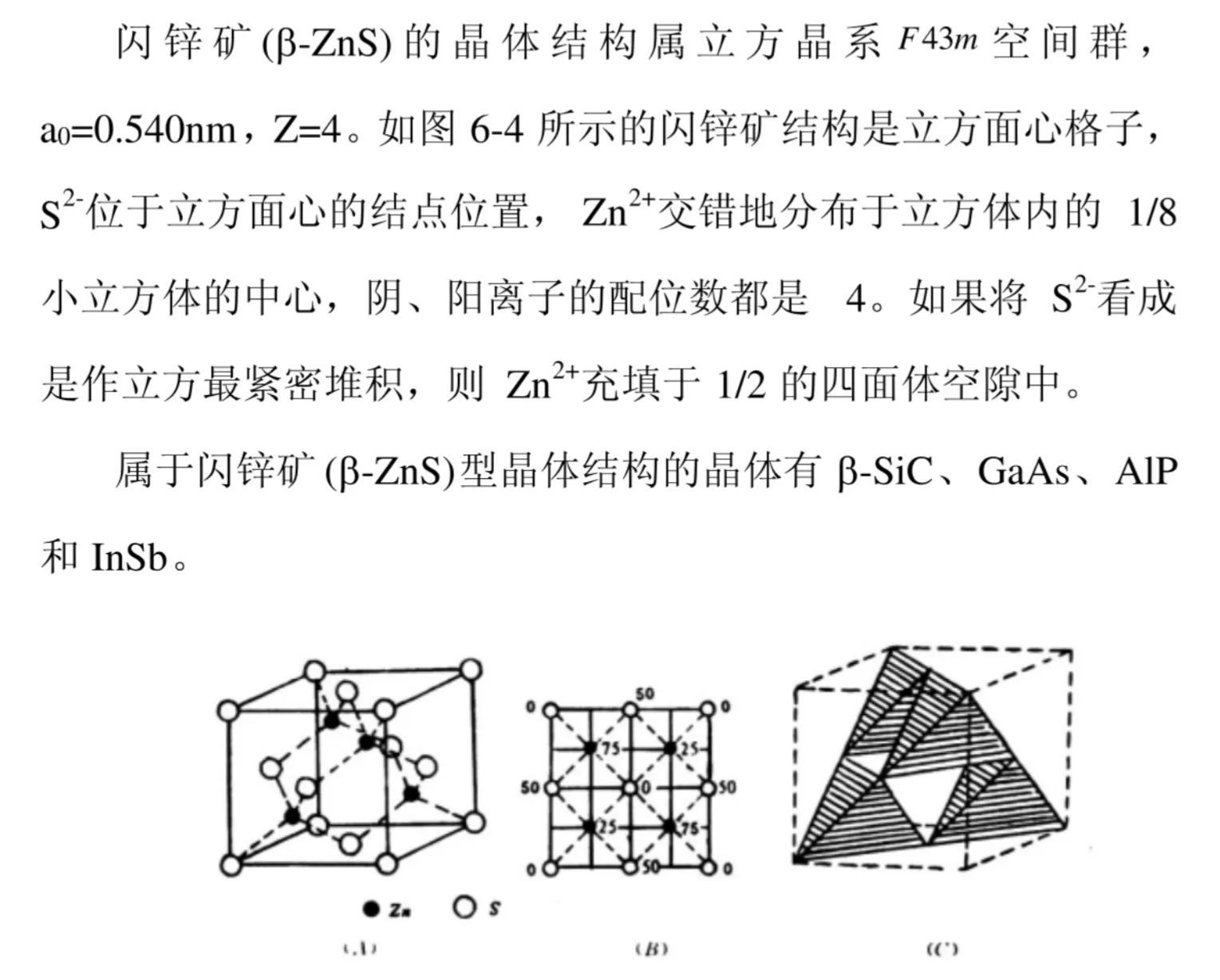
由于立方硫化锌结构可看作S原子作立方最密堆积、Zn原子占据一半四面体空隙形成,填隙时Zn原子互相间隔开,使填隙四面体不会出现共面连接或共边连接,降低了Zn原子之间排斥力,有利于体系稳定。由于Zn原子占据一半四面体空隙,故立方硫化锌结构中Zn原子与S原子个数比为4:4 = 1∶1。Zn和S之间按四面体的方式成键。
(2)六方硫化锌又名纤锌矿,其结构可看作S原子作六方最密堆积、Zn原子占据一半四面体空隙形成。六方最密堆积的晶胞拥有的原子个数:4×1/6+4×1/12+1=2
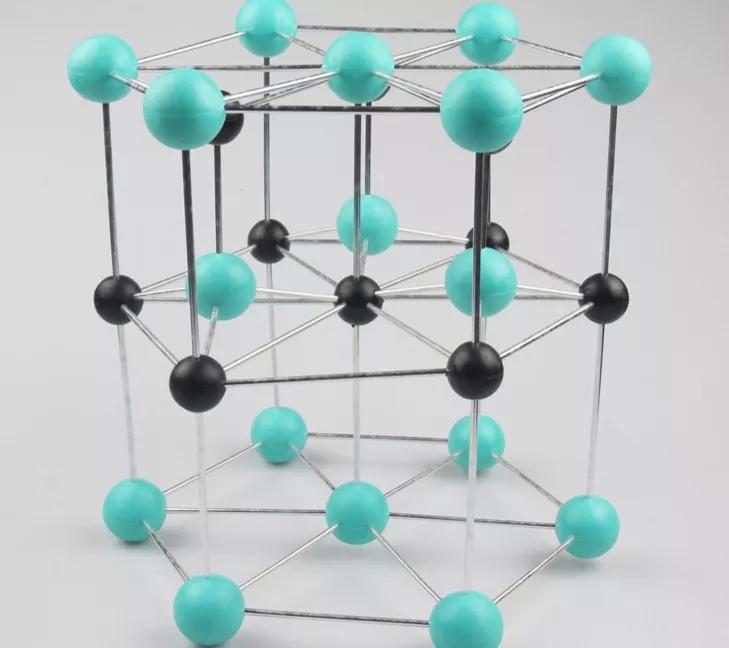
六方硫化锌结构图示
六方晶胞有两种空隙:八面体与四面体空隙。任何四个相切的球围成一个正四面体空隙。两个四面体空隙均在晶胞内部;其余四面体空隙由晶胞顶点八个球分别与中间层围成,两个四面体共面连接成三方双锥形,中心落在与c轴平行的四条棱边上,一个晶胞的正四面体空隙数为2+4×1/3+4×1/6=4个。
三维堆积时若同一个密置层相切的三个球体若与相邻的另一密置层三个相切的球体空隙对应(中间没有球体),这六个球将围成正八面体空隙,晶胞内部在第一与第二、第二与第三密置层共面形成2个正八面体。故六方最密堆积晶胞原子个数∶八面体空隙数∶四面体空隙数=2∶2∶4。
由于六方硫化锌结构可看作S原子作六方最密堆积、Zn原子占据一半四面体空隙形成,填隙时Zn原子互相间隔开,使填隙四面体不会出现共面连接或共边连接,降低了Zn原子之间排斥力,有利于晶体稳定。
由于Zn原子只占据一半四面体空隙,故六方硫化锌结构中Zn原子与S原子个数比为2∶2=1∶1。一个六方硫化锌晶胞含2个“ZnS”微粒。Zn和S都按四面体的方式成键。
闪锌矿结构中,各化学键键长相同。而纤锌矿结构中,一个原子与其临近原子形成的键长不同,沿竖直方向的键长大于其他三个键长。

键长示意图,左为闪锌矿,右为纤锌矿
硫酸铵晶体的结构及应用
一直以来,人们认为铵盐晶体中铵根和酸根离子之间是通过共价键结合的。但通过X射线衍射实验发现,1个(NH4)2SO4晶胞中含有4个硫酸根离子和8个铵根离子。实验测得,“H•••O”原子间的距离为199pm,小于H和O的范德华力之和272pm,大于H—O共价键的键长96pm,说明二者之间的作用力大小在范德华力(分子间作用力)和共价键之间,且N—H与H•••O之间的角度为156°,也符合形成氢键的条件。由此可知,铵根离子或硫酸根离子之间存在氢键(N—H•••O)。
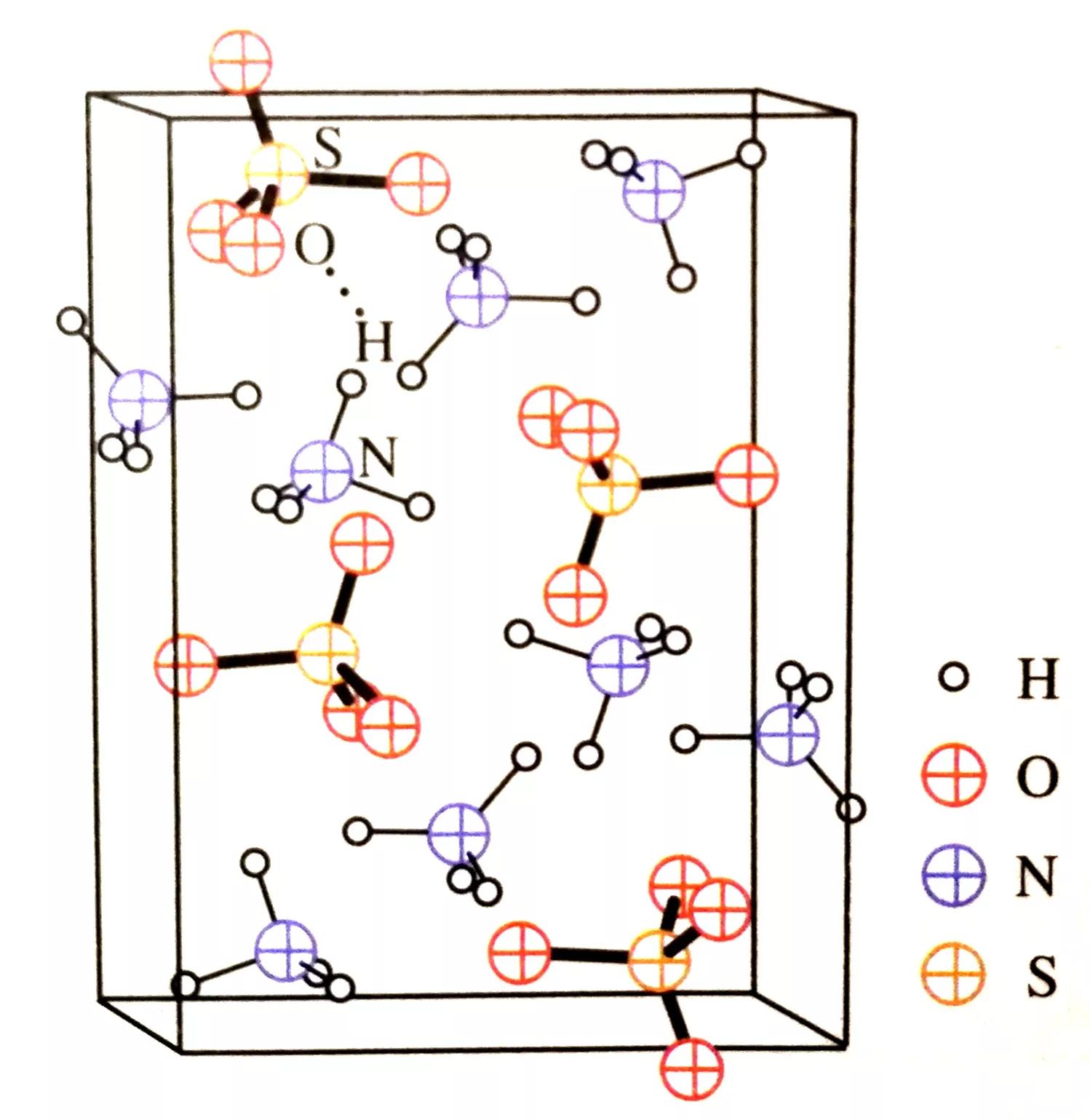
硫酸铵晶体的结构
宏观上看,硫酸铵是白色结晶性粉末,水溶液呈酸性,不溶于醇、丙酮和氨水。有吸湿性,吸湿后固结成块。加热到513℃以上完全分解成氨气、氮气、二氧化硫及水。与碱类反应放出氨气。与氯化钡溶液反应生成硫酸钡沉淀。可使蛋白质发生盐析。
硫酸铵可用作优良氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥。
与食盐进行复分解反应制造氯化铵,与硫酸铝作用生成铵明矾,与硼酸等一起制造耐火材料。加入电镀液中能增加导电性。也是食品酱色的催化剂,鲜酵母生产中培养酵母菌的氮源,酸性染料染色助染剂,皮革脱灰剂。还用于啤酒酿造,化学试剂和蓄电池生产等。
开采稀土。开采以硫酸铵作原料,采用离子交换形式把矿土中的稀土元素交换出来,再收集浸出液除杂、沉淀、压榨、灼烧即成稀土原矿。
用于蛋白纯化工艺方面。硫酸铵属于惰性物质,不易与其他生物活性物质发生反应,在纯化过程中能最大程度地保护蛋白活性。另外,硫酸铵的可溶性极好,能形成高盐环境,对于蛋白沉淀与后续的高盐纯化做准备。